LE COURANT ÉLECTRIQUE - LES ÉLECTROLYSES
<= Notes sur les pratiques techniques
Le sens conventionnel du courant a été choisi tel que dans l'électrolyse de l'eau, le courant va de l'électrode d'où se dégage l'oxygène (anode) à celle où se dégage l'hydrogène (cathode). Le courant va conventionnellement du pole + vers le pole -. Le sens réel est opposé.
Ainsi dans un générateur, conventionnellement, le courant sort de la cathode et entre dans l'anode. Dans un récepteur, il entre dans la cathode et sort de l'anode.
La différence de potentiel est définie par le travail des forces appliquées à la charge q lors de son déplacement entre les points A et B: WAB=q(VA-VB)
Effets du courant électrique:
- Loi de Joule: quantité de chaleur dégagée par un courant: W=RI2t
- Électrostatique: due à des charges statiques, existence d'un champs électrique E
- Électromagnétisme: du à des charges électriques en mouvement, existence d'un champs magnétique B
- Chimiques: électrolyse
Faraday: charge électrique portée par une mole 1F=96500C
Coulomb: quantité d'électricité traversant une section de conducteur parcouru pendant 1 s par un courant de 1A. 1C=6,241x1018 charges élémentairesMesure: La mesure de la tension se fait en plaçant le voltmètre en parallèle par rapport aux deux points du circuit dont on veut mesurer la ddp. En continu la mesure peut être positive ou négative selon que l'on a relié la borne + du voltmètre au point le plus positif ou le plus négatif.
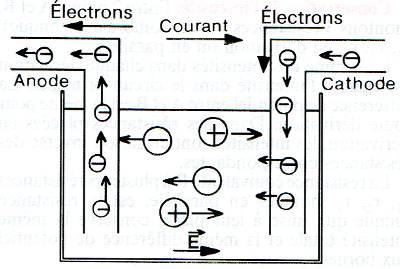
- La cathode est reliée au pôle - où il y a gain d'électrons (réduction). Les ions positifs (cations) migrent vers elle (sens du champs E) où il y a dégagement de H2(g) ou dépôt de métal
- L'anode est reliée au pôle + où il y a pertes d'électrons (oxydation). Les ions négatifs (anions) migrent vers elle (sens inverse du champs E) où il y a dégagement de O2(g), Cl2(g), etc.
Échelle d'éléctronégativité des métaux, du moins réducteur aux plus réducteurs:
Ag, Cu, H, Pb, Sn, Fe, Zn, Al, Mg, Alcalins
Les électrolytes peuvent être trés divers, mais de trois types principaux:
- acide
- basique
- solutions salines
Masse libèrée dans le cas où un seul corps simple apparait (loi de Faraday 1834):
m=(1/96500)(A/n)It
- m masse en g
- A masse atomique (g)
- n valence
- I courant en Ampères
- t temps en s
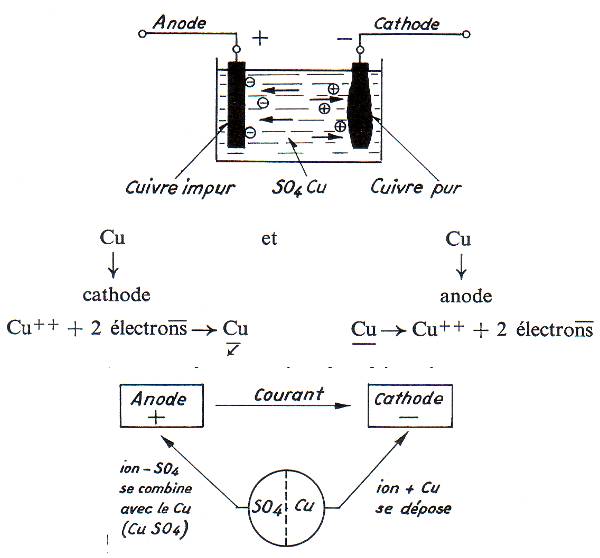
Purification du cuivre: la concentration de CuSO4 est constante lors de la réaction car il s'en crée constamment à l'anode. Il y a dépôt de cuivre presque pur à la cathode
Électrolyse de l'eau: On utilise comme électrolyte l'acide sulfurique H2SO4, ce qui rend l'eau conductrice. De plus l'anion SO42- est trés difficile à oxyder et donc ne perturbe pas l'opération. On a un dégagement de O2(g) à l'anode et de H2(g) à la cathode. La réaction globale est:
2H2O(l)->2H2(g)+O2(g)
Électrolyse de la saumure: la saumure est une solution aqueuse d'un sel, saturé ou de forte concentration, généralement du chlorure de sodium NaCl. On l'utilise pour la conservation des aliments (e.g. olives). Lors d'un salage à sec, il se forme spontanément de la saumure. Lors de l'électrolyse il se forme du chlore gazeux Cl2 à l'anode et du dihydrogène H2 à la cathode, où le sodium se combine à l'eau pour donner de la soude:
2Cl-(aq)+2H2O(l) -> H2(g)+Cl2(g)+2OH-(aq)
Il s'agit d'une des méthodes industrielle de production d'hydrogène.