LES PHÉNOMÉNES DE CORROSION
<= Notes sur les pratiques techniques
Définition: attaque des métaux et de leurs alliages, le plus souvent par réaction électrochimique entre le corps attaqué et le milieu environnant. les agents de la corrosions sont:
- Gaz chauds ou humides
- Eau ou solutions aqueuses
- Certains composés chimiques
Le plus souvent la corrosion se forme par oxydation en surface du métal:
- Couches d’oxydes imperméables => le phénomène s’arrête
- Couche d’oxydes perméables => la corrosion se poursuit en profondeur
Corrosion en milieu humide des matériaux ferreux: à partir d’un atome on obtient un ion positif si on retire un électron, un ion négatif si on ajoute un électron. Le sel et l’eau, presque tous les métaux, acides, bases, sont susceptibles de se ioniser en solution. Ionisation du fer en milieu humide :
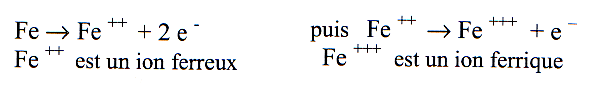
Du fer plongé dans de l’eau crée une électrode, la migration des électrons crée un courant de corrosion définissant un potentiel. Comme le métal fournit des électrons nous avons une anode. On devrait obtenir un équilibre chimique. Il n’en est rien à cause de l’existence d’un autre couple susceptible de capter ces électrons. Deux cas possibles:
-
l’eau ne contient pas d’oxygène. Elle contient en revanche des ions H+ dont la concentration définit le Ph, donnant ainsi une électrode d’hydrogène (cathode car elle prend des électrons):
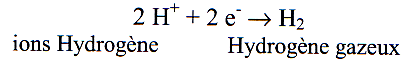
-
l’eau contient de l’oxygène, on a une électrode d’oxygène (cathode car elle prend des électrons) :
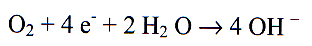
La corrosion se produit car nous avons affaire à un couple de corrosion, se produisant en circuit fermé; ensuite se forme la rouille:
- Fe++ +2(OH-) -> Fe(OH)2 (hydroxyde ferreux)
- Fe(OH)2 + O2 -> Fe(OH)3 (hydroxyde ferrique, alias rouille)
L’hydroxyde ferrique, peu soluble dans l’eau, se dépose à la surface du métal, mais ce dépôt est poreux et laisse passer les ions, la corrosion pouvant ainsi se poursuivre en profondeur; à noter que la formation de piqûres est typique de la corrosion à l’oxygène.
Corrosion à la ligne d’eau: due à la différence du taux d’oxygène dans les couches d’eaux successives à partir du niveau libre, souvent visible dans les réservoirs métalliques ou sur les murs de quais en palplanches.
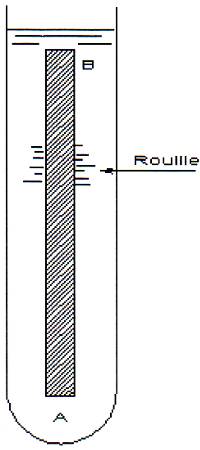
- on remplit une éprouvette verticale avec une solution de chlorure de sodium totalement désaérée
- on plonge une barre de fer pur AB
- au bout de quelques heures l’oxygène de l’air arrive seulement à pénétrer dans la partie haute de l’éprouvette
- on a alors en A une anode, attaquée, et en B une cathode; la rouille apparaît, en suspension entre A et B, à la rencontre des produits cathodiques et anodiques
Corrosion galvanique: Deux métaux différents mis en contact direct ou par l’intermédiaire d’un conducteur (électrolyte, etc.) vont se corroder, le métal le plus noble se déchargeant sur l’autre. Ce phénomène peut être arrêté ou accéléré si des courants parasites passent. Du plus noble vers le moins noble:
Pt>Au (or)>Ag (argent)>Acier inoxydable>Ni>Bronze>Cu>Laiton>Pb>Fe>Al>Zn>Ma
Corrosions biologiques: elle se fait par des bactéries.
- A l’intérieur des conduites on a des bactéries aérobies: (bactéries+O2)+fer-ferreux->fer-ferrique+énergie-vitale
- A l’extérieur des conduites on a des bactéries anaérobies: bactéries anaérobies -> réduction des sulfates -> O2 -> O2+H2->énergie-vitale
Dans les deux cas la corrosion est indirecte, l’accumulation de bactéries modifiant la teneur en oxygène en certain points, d’où aération différentielle et corrosion locale
Solution: L’addition de poly-méta-phosphates à l’eau circulant dans les conduites donne de bons résultats de protection par formation d’une couche protectrice.
Corrosion sous tension mécanique: des contraintes mécaniques élevées entraînent des attaques localisées selon les contours des grains des cristaux du métal:
- Phénomènes insensibles pour les aciers ordinaires
- Phénomènes possibles pour les aciers inoxydables et austénitiques
- Certains alliages légers peuvent y être très sensibles (e.g. aluminium, zinc)
Corrosion par courants vagabonds: courants électriques circulant dans le sol, e.g. courants de mise à la terre. Une corrosion anodique se produit là où le courant vagabond quitte le métal, corrosion d’autant plus sérieuse qu’elle est localisée.
Solution: revêtement localisé bitumeux suffisamment isolant
Corrosion par cavitation: lorsqu’un fluide est en mouvement dans une canalisation à grande vitesse, la pression statique peut devenir inférieure à sa tension de vapeur et on assiste à la formation de bulles de gaz qui implosent lorsqu’elles sont entraînées dans une zone de pression supérieure. La pression locale peut alors être très forte et fatiguer localement le métal.
Corrosion atmosphérique: on n’a pas de corrosion atmosphérique en air sec et non pollué. En revanche plus l’air est humide et plus il est pollué, plus il y a corrosion. L’agressivité de l’atmosphère humide est directement fonction de son degré de pollution, les pollutions gazeuses pouvant accélérer très fortement ce processus: chlore, hydrogène sulfuré, anhydride sulfureux.
Corrosion par l’eau de mer: l’eau de mer présente au large une stabilité remarquable de ses caractéristiques physico-chimiques (brassage des courants marins):
- Salinité: sels anhydres 30 à 37g/kg-eau
- Eau légèrement alcaline pH ci. 8
- Etc.
Ces limites sont moins serrées au niveau de cotes à cause des précipitations, fleuves, teneurs en alluvions…
Facteurs influents: l’influence prépondérante de l’oxygène tient au fait que les réactions anodiques et cathodiques ne peuvent avoir lieu sans lui, pas d’oxygène, pas de corrosion!
- Photosynthèse (algues): 6CO2+6H2O->C6H12O6+6O2; elle augmente la teneur en oxygène et en présence d’une colonie d’algues marines, la corrosion est proportionnelle à celle-ci.
- Température: la vitesse de formation de la rouille augmente de 5% entre 20 et 60°C; de plus la teneur en oxygène aux températures moyennes l’augmente fortement. D’où le fait que l’acier immergé soit très attaqué par l’oxygène aux températures moyennes (10-30°C)
- Salinité: principalement du chlorure de sodium; en fait la corrosion n’augmente que très lentement avec la salinité
Sels ayant une action déterminante sur la corrosion de l’acier à l’eau de mer:
- Chlorure de magnésium: 3g/l ; il a une action inhibitrice certaine; grâce à sa présence l’eau de mer est moins agressive qu’une simple solution de NaCl de même concentration.
- Carbonate de calcium: 0.1g/l ; joue un grand rôle car il précipite à la surface du métal en formant des dépôts protecteurs
Comportement des différents aciers: à noter qu’un acier n’est pas inoxydable ‘en soi’ mais par rapport à un certain milieu
- Aciers ordinaires non protégés: perte de 8g/dm²/an
- Aciers inoxydables à 17% Cr: attaqués
- Aciers inoxydables à 18% Cr et 10% Ni : attaqués
- Aciers inoxydables plus chargés ou avec du Mo: résistent bien
Corrosion du zinc: cf. page sur le zinc
Corrosion du plomb: cf. page sur le plomb
Corrosion du cuivre: cf. page sur le cuivre
Corrosion de l'aluminium: cf. page sur l'aluminium
Lutte contre la corrosion: elle consiste à:
- bloquer les réactions anodiques => interdire la migration des électrons et des ions ferreux
- bloquer les réactions cathodiques => contrôler les ions H+ et l’oxygène
Moyens pratiques:
- isoler parfaitement le métal par un revêtement inattaquable
- renverser le courant du couple de corrosion, i.e. protection cathodique, i.e. on allie le fer à un autre métal (zinc, Mg) qui joue alors le rôle de cathode et non plus d’anode.
- Polariser la réaction électrochimique:
- Eliminer l’oxygène par un réducteur
- Introduire un inhibiteur de corrosion qui bloque la réaction
=> nécessité d’un décapage sérieux avant tout traitement (sinon on enferme le loup dans la bergerie). On doit aussi éliminer graisses et huiles par les solvants habituels.
Procédés:
- Dépôts superficiels électrolytiques d’un métal plus noble (Cr, Ni…)
- Galvanisation à chaud: immersion de courte durée dans un bain de zinc à 450°C
- Etamage à chaud: dépôt d’étain à chaud
- Chromisation: cémentation par le chrome
- Phosphatation: film insoluble de phosphate de fer obtenu en plongeant la pièce vers 95°C dans un bain de phosphates de fer
- Peintures
- Protection cathodique: anodes en zinc ou en magnésium (constructions navales ou constructions souterraines)
- Inhibiteurs cathodiques: leur cation forme avec la cathode un produit insoluble (chlorure de magnésium ou sulfate de zinc)
- Inhibiteurs anodiques: leur anion forme avec l’anode de la pile un composé insoluble (phosphate de sodium, bichromate de potassium, carbonate de sodium)
- Revêtement par matière plastique:
- On chauffe la pièce de métal au dessus du point de fusion de la matière plastique
- On saupoudre celle-ci sur la surface de métal chauffé (polyamide ou polyéthylène)
- On obtient une pellicule lisse et sans faille
Parkérisation: la pièce est traitée par une solution chaude de :
- phosphate de manganèse
- phosphate de zinc
- acide phosphorique
Passivation: l'acide phosphorique crée un dépôt de phosphate de fer, d'où passivation et amélioration de la tenue à la corrosion des revêtements de peinture.