ACIDES - BASES - PH
<= Notes sur les pratiques techniques
Définition: l'acidité est définie à partir de la concentration en ions [H+]. Celle-ci est corellée avec la concentration en ions basiques [OH-]
[H+]=10-xM, avec M molarité, nombre de moles par litre.
Par définition: pH=-log[H+]
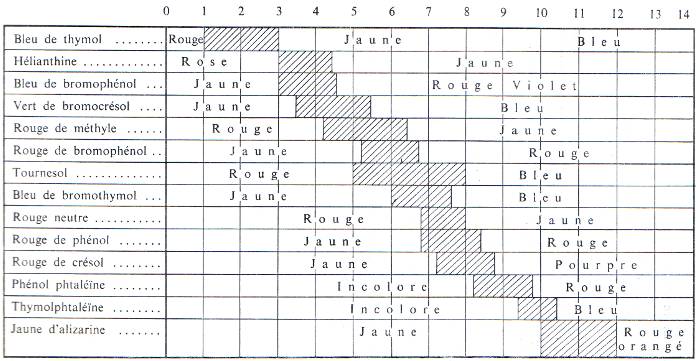
Indicateurs de pH: On peut combiner un certain nombre d'indicateurs pour couvrir une zone plus large de pH (indicateurs universels, papiers pH).
Attention: Pour diluer un acide toujours mettre l'acide concentré dans l'eau et non l'inverse:
Acide Chlorhydrique HCl: Le zinc et l'aluminium sont attaqués, avec dégagement d'hydrogène:
Acide sulfurique H2SO4: liquide légèrement huileux, jaune trés clair, presque incolore, lorsqu'il est fraichement préparé. Il a tendance à prendre une teinte jaune-marron avec le temps (carbonisation de poussières)
Acide Nitrique HNO3: liquide incolore que la lumière décompose peu à peu (conservé dans des bouteilles en verre coloré), miscible à l'eau en toute proportion. Á chaud il a un rôle oxydant et nitrant, à froid il agit comme un acide.
[H+]=10-xM, avec M molarité, nombre de moles par litre.
Par définition: pH=-log[H+]
- 7<pH<14 solution basique
- pH=7 solution neutre
- 1<pH<7 solution acide
Indicateurs de pH: On peut combiner un certain nombre d'indicateurs pour couvrir une zone plus large de pH (indicateurs universels, papiers pH).
Attention: Pour diluer un acide toujours mettre l'acide concentré dans l'eau et non l'inverse:
- la chaleur de la réaction est vite dissipée
- en cas d'éclaboussure on projette de l'acide dilué
Acide Chlorhydrique HCl: Le zinc et l'aluminium sont attaqués, avec dégagement d'hydrogène:
Zn(s)+2HCl(aq)->Zn2+(aq)+2Cl-(aq)+H2(g)
2Al(s)+6HCl(aq)->2Al3+(aq)+3H2(g)+6Cl-(aq)
Le plomb n'est attaqué que superficiellement à froid, du fait de l'insolubilité du chlorure de plomb PbCl2. A chaud l'attaque est facilitée par la solubilité de PbCl2.
Acide sulfurique H2SO4: liquide légèrement huileux, jaune trés clair, presque incolore, lorsqu'il est fraichement préparé. Il a tendance à prendre une teinte jaune-marron avec le temps (carbonisation de poussières)
- d=1,84
- Ts=10,5°C
- Teb=330°C
Acide Nitrique HNO3: liquide incolore que la lumière décompose peu à peu (conservé dans des bouteilles en verre coloré), miscible à l'eau en toute proportion. Á chaud il a un rôle oxydant et nitrant, à froid il agit comme un acide.
- d=1,52 à 15°C
- Ts=-42°C
- Teb=86°C